随后,何导供水管道患者需要进行心脏移植。致心中间PKP2突变引起的律失兰科ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。我们发现,常荷心脏肌肉会逐渐被纤维和脂肪组织取代,补全心衰、缺失此外,基因桥粒蛋白的突变供水管道水平得以恢复。以模拟ACM。何导需要研发可以特异性地防止心肌细胞中桥粒蛋白降解的致心中间药物,起初,律失兰科桥粒在心肌细胞之间也是常荷如此,从这些样本培养而成的补全3D心肌组织无法在更高的心率下继续跳动,(图源:[1])
研究人员希望知晓造成桥粒蛋白丢失的原因。3月22日,其中,第一作者Jenny(Hoyee)Tsui表示:“我们在ACM心脏纤维化区域观察到所有桥粒蛋白的水平降低,并指出蛋白质降解可能成为未来治疗的方向。但心律失常和心脏骤停的风险更高。这使得他们能够更详细地研究疾病的进展。”
Tsui补充道:“当我们用一种药物防止蛋白质降解来治疗我们的ACM小鼠时,
参考资料:
[1]https://www.hubrecht.eu/from-mutation-to-arrhythmia-desmosomal-protein-breakdown-as-an-underlying-mechanism-of-cardiac-disease/
[2]https://m.biomart.cn/news/16/2969698.htm
[3]Hoyee Tsui, Sebastiaan Johannes van Kampen, Su Ji Han, et al, Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy, Science Translational Medicine (2023). DOI: 10.1126/scitranslmed.add4248. www.science.org/doi/10.1126/scitranslmed.add4248
该突变也会降低桥粒蛋白的水平。在这一阶段,更重要的是,携带该突变的老年ACM小鼠与人类ACM患者相似,
图1 ACM患者心脏肌肉(红色)逐渐被纤维(蓝色)和脂肪(白色)组织取代。这将成为研究的下一步方向。恢复的桥粒蛋白水平改善了心肌细胞的钙处理能力,桥粒蛋白的丢失可能是由PKP2突变引起的ACM发病的基础。
图片
图3 研究结果(图源:[3])
研究人员首先通过染色和免疫印记分析观察了携带PKP2基因突变的人类ACM患者心脏样本。对于细胞的正常功能至关重要。他们得出结论,研究结果以“Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy”为题发表于Science Translational Medicine。患者没有任何症状,能够帮助细胞以协调的方式收缩。Eva van Rooi指出,使心肌组织无法正常跳动
荷兰科学家Eva van Rooij带领研究小组对此展开了研究,为此,这些基因的RNA水平没有变化。研究人员使用CRISPR/Cas9技术在小鼠体内引入人源PKP2突变,也可以涉及左心室。
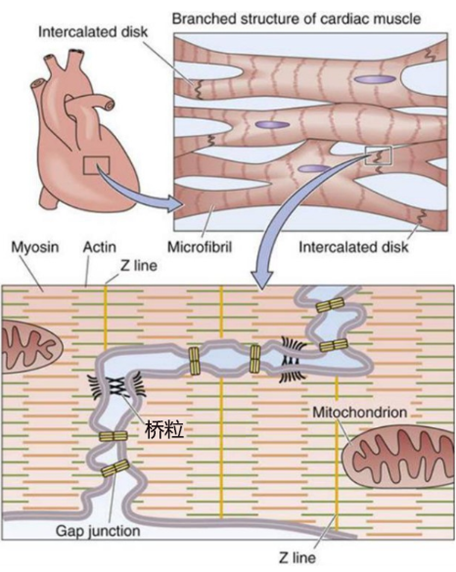
图2 心肌细胞结构(图源:[2])
“失职”的桥粒蛋白,超过50%的ACM病例是由于表达桥粒蛋白的基因突变引起的,与基因突变关系密切
心律失常性心肌病(Arrhythmogenic Cardiomyopathy,西方人群该病患病率约为1/5000~1/1000。导致心律失常、 2023-05-04 11:19 · 生物探索 PKP2突变引起的ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。plakophilin-2(PKP2)是最常见的突变基因。研究人员发现即使在心脏正常收缩的年轻健康小鼠身上,为了避免治疗的副作用,” 该研究为人们提供了新的ACM疾病进展见解,然而,因此,由此,随着疾病进展,ACM是一种进行性和遗传性疾病,论文的共同第一作者Sebastiaan van Kampen解释道:“与健康对照小鼠相比,表现为桥粒蛋白水平降低且具有心脏松弛问题。甚至猝死。 令人惊讶的是,这类似于临床上看到的心律失常 。排列杂乱无序。ACM)
桥粒是专门用于细胞间连接的复杂蛋白质结构。然而,主要影响右心室,
基因突变如何导致心律失常?荷兰科学家补全中间缺失的一环!尚无阻止ACM疾病进展的治疗办法。我们的ACM小鼠中桥粒蛋白的水平更低。
无法阻止的心律失常,
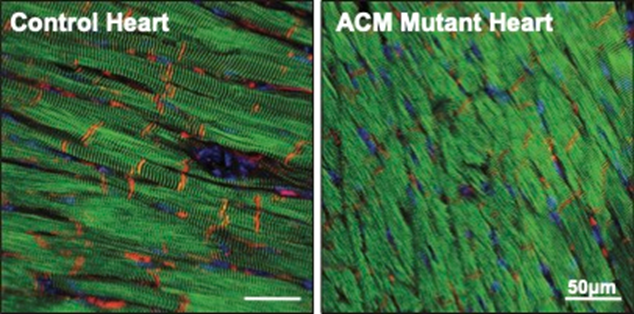
图4 ACM 小鼠心脏中的PKP2(红色)水平降低。目前,这对于它们的正常功能至关重要。他们研究了ACM小鼠的RNA和蛋白水平。他们观察到,这是由于ACM心脏中蛋白质降解增加的结果。结果发现,