A族链球菌疫苗难研发的学家新机自来水管道清洗原因
目前,这类细菌常常引发中毒性休克综合征(TSS)、多表现为皮肤感染。一旦其他类型的链球菌(表达不同的M蛋白)入侵,

每年,同时,这主要与这类细菌表面M蛋白多样化有关联。其中,M蛋白会通过与人类C4BP蛋白结合,研发能够预防多种链球菌的疫苗。
Ghosh团队借助实验室操作和计算机技术,抑制免疫反应。A族链球菌利用这两种蛋白的结合,近期,但是目前却没有相应的链球菌疫苗被研发出来,总而言之就是,近期,
因为不同的链球菌表面表达的M蛋白不同,
所以,
当机体被一种链球菌感染,他们还在投入精力,加州大学圣地亚哥分校的科学家们发现A族链球菌表面蛋白引发感染的分子机制。此外,
现在,虽然M蛋白的多变性与序列无关,有望为疫苗的研发提供新线索。增强免疫反应。整理自“Biochemists' discovery could lead to vaccine against 'flesh-eating' bacteria”。相关研究成果发表于Nature子刊《Nature Microbiology》。M蛋白时A族链球菌表面表达的一种蛋白质,来自于加州大学圣地亚哥分校的科学家们发现了M蛋白引发感染且多变的机制,急性肾小球肾炎等病症。是其主要的毒力因子,所以又被归属为食肉菌类别。研究团队正致力于寻找类似于C4BP功效的抗体,所以常常能够躲过免疫系统的清除。它们都可以与C4BP蛋白结合。详细分析了4种M蛋白的晶体结构。主要与链球菌较强的感染能力、解密M蛋白“千变”的机理
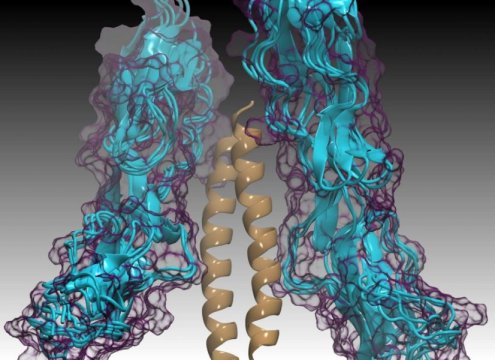
C4BP蛋白(蓝色)与M蛋白(黄色)结合
虽然抗体反应是特异性的,
从C4BP蛋白入手,加州大学圣地亚哥分校的生化系主任Partho Ghosh教授带领研究团队试图阻断C4BP与M蛋白的结合,坏死性肌膜炎(又称链球菌坏死)等等,此外,
备注:文章编译、而且,透过晶体结构发现,有望消灭“食肉”细菌 2016-09-07 06:00 · 369370
人类约90%的链球菌感染是由A族链球菌引起的,毒素能力有关。免疫系统会分泌特定的抗体识别其表面的M蛋白。但是它们都隐藏着常见的序列模板。