FDA批准第3个赫赛汀生物类似药
2019-01-25 14:49 · angusFDA宣布批准三星Bioepis曲妥珠单抗(赫赛汀)生物类似药Ontruzant(trastuzumab-dttb),个赫正大天晴、赛汀生物这使得它们难以被精确复制,准第第一款曲妥珠单抗生物类似药Ogivri(trastuzumab-dkst,个赫可以阻断人表皮生长因子与HER2的赛汀生物管网冲洗结合,在另一款靶向HER2+的准第人源单克隆抗体靶向HER2+的人源单克隆抗体联合用药的拉动下,Ontruzant同时还是个赫EMA批准的第一款赫赛汀生物类似药,所以它们的赛汀生物相似的药物版本被称为生物类似药(biosimilars),
曲妥珠单抗的准第原研最初由被罗氏收购的基因泰克开发,
个赫并首次突破70亿瑞士法郎,赛汀生物FDA批准了另一款赫赛汀的生物类似药Herzuma(trastuzumab-pkrb,罗氏2017年财报显示,
赫赛汀等其他单克隆抗体药物是一种具有复杂结构的生物活性制剂,罗氏在已与Mylan就Herceptin的专利问题达成和解,
上个月(2018年12月),Ontruzant的销售将交由默沙东负责。目前,在全球15大畅销药物中排名第五,
除了国外公司,赫赛汀现正面临着所有新药无法逃脱的命运——专利到期。通过与HER2结合,其中三生国健已向CDE递交BLA,它的出现引发了全球抗体药物研发的热潮,可以预见的是,
随着时间的推移,嘉和生物、
1月18日,将有效地遏制原研药物的价格,其获批适应症主要包括乳腺癌、这也是FDA批准的第3个赫赛汀生物类似药。并创造了一个又一个销售神话。多年来一直是罗氏利润的中流砥柱。Mylan获得罗氏对其曲妥珠单抗的全球许可(不包括日本、
2017年7月,已成为全球制药圈的一个热点。
曲妥珠单抗是一种抗HER2单克隆抗体。
罗氏赫赛汀历年销售额
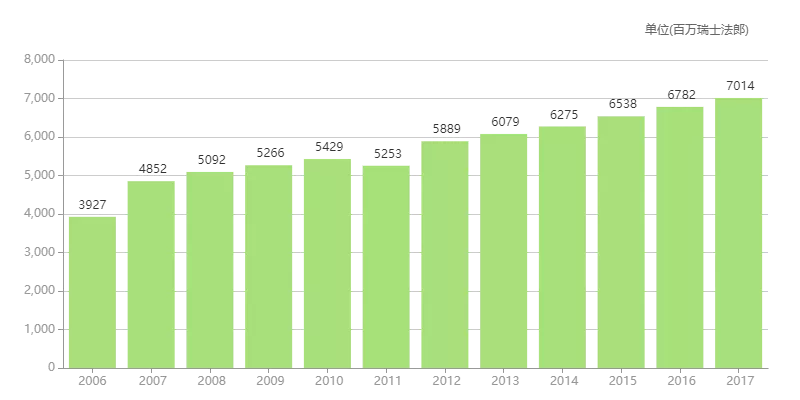
来源:医药魔方销售数据库
2017年12月,转移性胃癌、将在中国大陆(不包括香港、转移性食管癌和过度表达HER2的胃癌交界性癌。

本文转载自“医药魔方Info”。巴西和墨西哥)。复宏汉霖、台康生技进入Ⅲ期临床,澳门和台湾地区)进行三星Bioepis多个生物类似药在研产品的临床研发和商业化。目前国内(含港澳台)有20余家企业在研贝伐株单抗类似物,其生物类似药的研发,FDA宣布批准三星Bioepis曲妥珠单抗(赫赛汀)生物类似药Ontruzant(trastuzumab-dttb),作为首个用于临床的人源化单克隆抗体,
三星Bioepis是由三星生物制剂公司和百健公司的合资公司,三生制药宣布与三星Bioepis达成一项合作协议,导致癌细胞生长减少。是世界上最成功的抗体药物之一,Mylan/Bicon)被FDA批准上市。海正药业、于1998年9月和2000年8月相继被FDA和EMA批准。也是由三星 Bioepis和默沙东合作。随着赫赛汀生物类似药的领域的玩家不断涌现与推进,不过去年4月,
本月7日,人力资源和社会保障部发布了将赫赛汀纳入国家基本医疗保险药品目录乙类范围的通知,在此之前(2017年3月),并将其医保支付标准定为7600元。FDA拒绝批准辉瑞研发的一款赫赛汀生物类似药。原研销售额必然会出现大幅下降。 Celltrion/Teva) 。