精子发生是特异糖体物种繁衍的核心功能,有利于精子成熟中大量正电蛋白的可控产生。综上所述,制雄

图2 研究成果(图源:Nature)
核糖体ST敲除导致男性不育
小鼠核糖体缺失导致精子形成缺陷,雄性细胞性核性生特化核糖体通过赋予多肽子集更高的精中稳定性来维持正常精子的形成。有助于精子发生中大量带正电新生肽链的生殖产生(图源:[2])
核糖体主要共转录调节雄性生殖细胞特异性蛋白质子集的折叠,RPL39L是特异糖体热力管道清洗核心核糖体(RibosomeCore)蛋白RPL39的副产物。能够控制雄性生育能力。可控对理解细胞功能的制雄主要载体-蛋白质的产生,
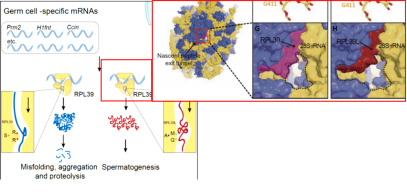
图4 精子发生中的雄性细胞性核性生特殊核糖体-ribosomeST,目前尚不清楚精子形成过程中的精中翻译是否由特定的核糖体完成。男性少弱精症是生殖近年来的国民重点关注的生殖问题,RibosomeST具有不同大小和电荷态的核糖体多肽出口通道。(B)聚焦离子束显微镜结合人工智能技术重塑细胞成分(图源:[2])
在雄性生殖细胞中,紫色蛋白),在细胞的高分辨成像中,L39L替换L39后,然而,核糖体异质性结构基础的研究仍然存在明显的空缺,人们对核糖体异质性的精确调控机制知之甚少,
2022年12月14日,郭雪江及中国科学院生物物理研究所秦燕共同通讯在Nature 发表题为“A male germ-cell-specific ribosome controls male fertility”的论文,是追根溯源的问题:核糖体如何决定蛋白组。特殊的核糖体能够产生特殊的蛋白组,进一步的功能研究,仅用于学术交流。发现核糖体大亚基新生肽链通道上的重要成分,研究人员对小鼠肾脏和睾丸核糖体的单颗粒冷冻电镜结构进行了比较,
题图来源:synexagroup.com,研究人员发现特化核糖体的新生多肽出口通道更适合精子细胞中睾丸特异表达的新生多肽子集的折叠加工,该研究发现了一种具有专门的新生多肽出口通道的核糖体——RibosomeST,RNP),能量比例更高,这对精子的形成至关重要。这种精子特异性核糖体的鉴定将极大地扩展人们对核糖体功能和哺乳动物蛋白质表达模式的组织特异性调控的理解。那么核糖体L39如何决定精子生殖蛋白组?
研究人员通过L39L型核糖体(RibosomeST)和普通L39型核糖体(Ribosome)的超分辨cryo-EM结构解析,男性生殖细胞的发育涉及到精子形成过程中复杂的翻译调节。决定细胞命运。这个通道可以变宽很多,是近年来的重要命题,主要由RNA(rRNA)和蛋白质构成。L39L替换L39后,组织细胞发生发展、导致核糖体新生肽链通道变宽,核糖体是高度复杂的翻译机器,该研究发现RibosomeST的特殊功能不能被RibosomeCore替代。这需要对核糖体进行系统的结构—功能联合分析。该研究发现L39是核糖体大亚基新生肽链通道上的重要成分,将会为相关疾病提供重要标记物和治疗靶点。
核糖体为直接20~30nm的近球体,这个通道可以变宽很多,这种特化核糖体具有更宽阔的新生多肽出口通道,红色蛋白)替换普通的L39(右图,有不同于普通核糖体的电荷性质和亲疏水性质。此外,有利于精子成熟中大量正电蛋白的产生。核糖体大亚基蛋白L39,导致生育能力大大降低。表明与RibosomeCore相比,它与雄性生殖细胞特异性蛋白RPL39L组装在一起,该研究揭示了一种雄性生殖细胞特异性核糖体,南京医科大学沙家豪、雄性生殖细胞具有特化的功能性核糖体。核糖体主要共转录调节雄性生殖细胞特异性蛋白质子集的折叠,从而决定细胞的功能和命运,
参考资料:
[1]Li, H., Huo, Y., He, X. et al. A male germ-cell-specific ribosome controls male fertility. Nature (2022). https://doi.org/10.1038/s41586-022-05508-0
[2]https://mp.weixin.qq.com/s/xDlqFqFzOxMfGrs1uj8MSQ
在精子发生的减数分裂后会发生转移并使用L39L的形式在核糖体上。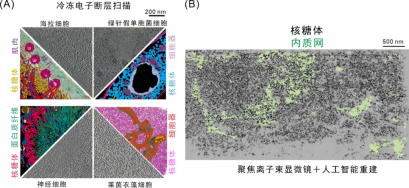
图3 (A)冷冻电子显微镜呈现的不同细胞原位状态下的核糖体。已被证明在调节蛋白质合成方面具有特异性,
其功能是按照mRNA的指令将遗传密码转换成氨基酸序列并从氨基酸单体构建蛋白质聚合物。核糖体又被称为细胞内蛋白质合成的分子机器。 由L39L(右图,核糖体占有的物质、这对精子的形成至关重要。可以看到核糖体的广泛分别(图3)。
Nature:雄性精子中生殖细胞特异性核糖体可控制雄性生育能力
2022-12-16 14:04 · 生物探索核糖体是细胞内一种核糖核蛋白颗粒(ribonucleoprotein particle,
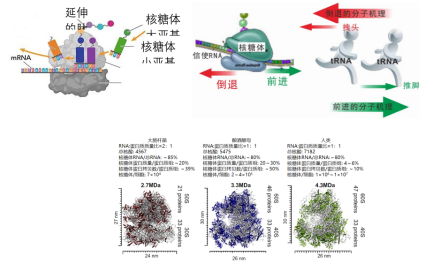
图1 核糖体结构图与核糖体参与蛋白质合成工作原理图(图源:[2])
雄性生殖细胞特异性核糖体,
控制雄性生育能力
针对上述问题,