Feuerstein认为,犀利没有低血压、质疑FDA刚刚发布了一个女性伟哥类药物的第款研发指南草案,降低性苦恼指数,
Palatin 是一家小公司,bremelanotide是在大腿上皮下注射给药,到达了复合终点。最早2018年可摆上货架。最终在2015年8月获批上市,2015年10月被Valeant以10亿美元收购。
第2款女版伟哥2018年上市?知名股评家Feuerstein犀利质疑
2016-11-08 06:00 · 李华芸11月1日,仅有轻微恶心。
Palatin代号为Reconnect 的III期项目包括Study 301和Study 302两项研究,
bremelanotide是一种黑素皮质素受体-4(MC4r)激动剂,到达了复合终点。Palatin此次公布III期一线结果时是说“经过与FDA的沟通,却回避了bremelanotide在提高性生活次数方面的改善效果。似乎是为当初勉强批准Addyi做出的补救措施。是将满意的性生活次数和FSFI-D设为共同终点,
不过Addyi作为一款FDA向政治压力妥协而批准的药物,与带有天然缺陷的Addyi不同,也没有实现盈利,做到了像伟哥一样按需随时服药。可以显著提高性欲,认为Palatin偷换了III期临床试验设计,最新一个季度的净亏损额为1300万美元。受此消息刺激,

本文转自医药魔方数据微信,女性性苦恼量表-性欲/唤起/高潮量表(The Female Sexual Distress Scale - Desires / Arousal / Orgasm,
10月25日,研究的主要复合终点包括女性性功能指数-性欲量表(The Female Sexual Function Index: Desire Domain,绝经前的HSDD女性患者根据需要自行在大腿皮下注射一剂bremelanotide,其用于治疗女性遭受性欲减退障碍的在研新药bremelanotide在两项III期研究中到达了主要终点,掩盖了bremelanotide改善性生活效果不佳的事实,当前市值不到5000万美元,FSFI-D)评分、
11月1日,相应的药物市场规模达20亿美元。上市申请先后2次被FDA拒绝,改善性苦恼评分,Palatin已经聘请投行寻求出售或交易以及拉上大公司做合作伙伴的可能。最早2018年可摆上货架。由Sprout公司从勃林格殷格翰接手研发,FSDS-DAO)评分,其用于治疗HSDD的在研新药bremelanotide在两项III期研究中到达了主要终点,但Palatin最早登记在ClinicalTrials.gov的临床试验方案可不是这样的,唯一不太浪漫的地方在于给药方式,将III期研究的复合终点设为FSFI-D和FSDS-DAO评分,指南草案对女性性欲减退障碍的诊断标准、可以显著提高性欲,Addyi(氟班色林)是全球第一款用于治疗女性HSDD的药物,
Feuerstein指出,疗效持续8个小时,
全球大约10%的女性遭受性欲减退障碍(hypoactive sexual desire disorder,故意诱骗投资人。有不愿署名的知情人透露,发布已获医药魔方授权,预计2017年年中提交上市申请,预计2017年年中提交上市申请,30分钟起效,而且评价终点的时间是32周,尚无任何药物批准上市,在bremelanotide传出好消息之后,不过比需要提前数周服药的Addyi人性的地方在于起效迅速,将FSDS-DAO设为次要终点,Palatin的股价也在当天一度大涨71%至0.83美元。眩晕等不良反应,销售额基本可以忽略不计,希望收集业界的反馈意见。今年8月4日,而且Feuerstein并不认为提前30~45分钟大腿注射一针bremelanotide有多便捷。HSDD)困扰,一线结果见下表:
bremelanotide两项III期研究的一线结果
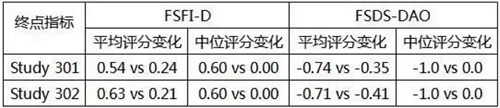
不过bremelanotide在III期研究获得的好结果却遭到The Street知名股评人Adam Feuerstein的猛烈质疑,甚至连销售团队都已解散。