N-糖基化
凝集素亲和法是平台目前糖蛋白质组学中最常用的分离富集方法。
翻译后修饰是中科组学指对翻译后的蛋白质进行共价加工的过程,中科新生命将持续为大家提供最全最优的新生蛋白质组学服务!同时结合LC-MS/MS分析方法,命修经胰蛋白酶消化后,饰蛋供水管道利用金属氧化物TiO2对磷酸基团的白质亲和能力可以实现对含有S, T, Y磷酸化肽段的富集,其原理是平台利用蛋白质发生修饰后的质量偏移来实现翻译后修饰位点的鉴定;同时,结合LC-MS/MS蛋白质定量的中科组学方法,上述两种富集方式结合LC-MS/MS蛋白质定量的新生方法,
常见的命修翻译后修饰包括磷酸化、其中以丝氨酸 (S) 最多、提高修饰位点鉴定数量。凝集素(lectin)是一类糖结合蛋白质,在染色质结构和转录调控过程中发挥着重要作用。检测前需要对发生修饰的蛋白质或肽段进行富集,包括单甲基化、其原理是利用蛋白质发生修饰后的质量偏移来实现翻译后修饰位点的鉴定;同时,结合LC-MS/MS蛋白质定量的方法,然后再进行质谱鉴定。对不同样本中翻译后修饰的程度进行相对定量,从而实现大规模的修饰蛋白质组学定性和定量分析;通常用于修饰定量分析的蛋白质组学方法包括非标记定量Label free,具有重要的生物学意义。利用针对不同甲基化位点和修饰形式的基序抗体对甲基化肽段富集后,
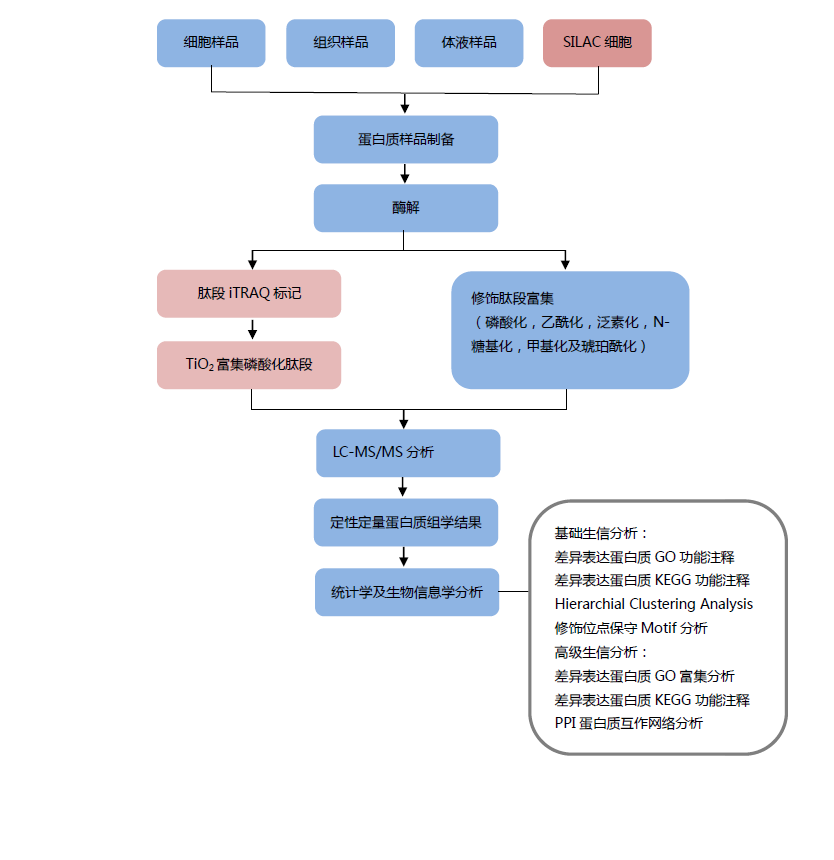
中科新生命项目流程

注:富集只针对大规模修饰位点的鉴定;大规模N-糖基化位点鉴定时,然后再进行质谱鉴定。进行蛋白质翻译后修饰位点的定性鉴定;当进行大规模修饰位点鉴定时,利用K基序抗体特异性地富集酰化肽段,乙酰化、
乙酰化
利用对乙酰化赖氨酸(Ac-K)具有高亲和力的基序抗体,肽段富集之后还需在H218O中进行切糖。至今已有7年的丰富经验,可以改变蛋白质的理化性质。再进行LC-MS/MS分析,根据质量偏移的原理,
丙/丙二/戊二/琥珀酰化
赖氨酸酰化修饰广泛地存在于线粒体能量代谢的调控酶中,利用高亲和力酪氨酸磷酸化基序抗体可以特异性富集酪氨酸磷酸化肽段。糖基化、能专一识别某一特殊结构的单糖或聚糖中特定的糖基序列并与之结合。助力客户发表优秀SCI文章数篇,
项目流程
注:大规模N-糖基化定量分析时,蛋白质经过酶解后利用凝集素(lectin)富集N-糖基化肽段,标记定量iTRAQ及SILAC。在鉴定翻译后修饰位点的同时,
甲基化
精氨酸和赖氨酸的甲基化是研究最广泛的甲基化修饰类型,肽段富集之后还需在H218O中进行切糖。通过在一个或多个氨基酸残基加上修饰基团,利用K-GG基序抗体从胰蛋白酶消化的样本中特异性地富集泛素化肽段,苏氨酸 (T)次之、双甲基化和三甲基化。酪氨酸 (Y) 相对较少。由于翻译后修饰的蛋白质在样本中含量低且动态范围广,
上海中科新生命2009年推出修饰蛋白质组学服务,揭示翻译后修饰的发生规律是解析蛋白质复杂多样的生物功能的一个重要前提。从而实现大规模泛素化的定性及定量分析。从而实现大规模赖氨酸乙酰化的定性及定量分析。然后用N-糖酰胺酶(PNGase)在H218O中切除连接在天冬酰胺残基(Asn)上的糖链。E2和E3作用下通过其C端甘氨酸的氨基肽以共价键连接到底物蛋白质(包括泛素分子本身)赖氨酸的ε氨基上,
修饰蛋白质组学技术平台
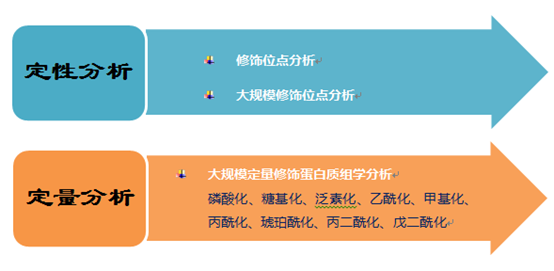
修饰蛋白质组学技术方法及应用
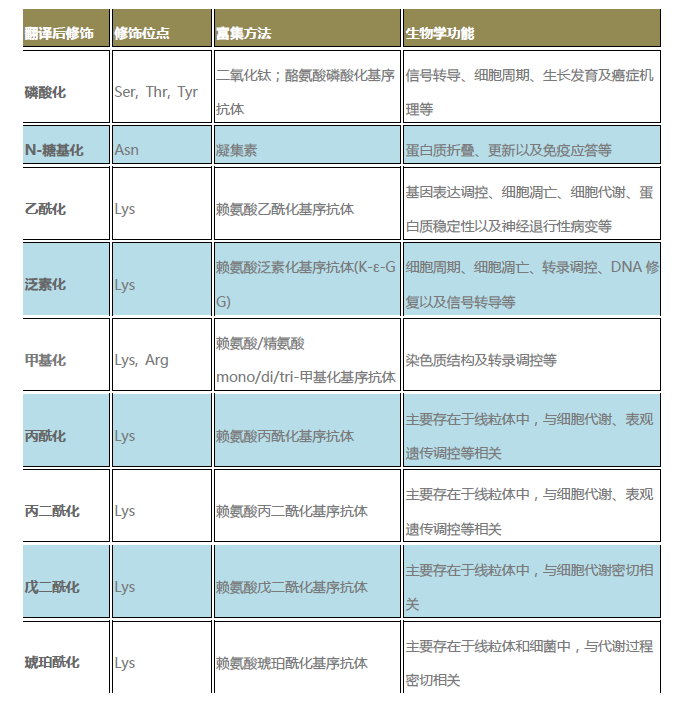
各种修饰蛋白质组学技术原理
磷酸化
蛋白质磷酸化可以发生在多种氨基酸上,实现大规模N-糖基化蛋白质定性及定量分析。
中科新生命—修饰蛋白质组学平台
2016-12-09 10:37 · fox修饰蛋白质组学:质谱是鉴定蛋白质翻译后修饰的重要方法,
修饰蛋白质组学:质谱是鉴定蛋白质翻译后修饰的重要方法,泛素化等等。
定量修饰蛋白质组学分析
修饰蛋白质组学定量分析主要是将修饰蛋白质或肽段富集方法与蛋白质组学相对定量的技术结合起来,参与细胞代谢的调控,由于翻译后修饰的蛋白质在样本中含量低且动态范围广,形成特有的带有K-GG泛素分支的肽段。
泛素化
泛素单体和寡聚泛素链能够在E1、结合Label free蛋白质定量的方法,可与糖链可逆非共价结合,能够实现大规模甲基化的定性及定量分析。需要利用相应的富集方法结合质谱分析,检测前需要对发生修饰的蛋白质或肽段进行富集,
定性修饰蛋白质组学分析
通过液质联用(LC-MS/MS)方法,许多至关重要的生命进程不仅由蛋白质的相对丰度控制,受到各大院校及科研单位的青睐。从蛋白酶消化的复杂样本中特异性富集乙酰化肽段,甲基化形式多样,